Nazwa produktu:Metyloetyloketon
Format molekularny:C4H8O
Numer CAS:78-93-3
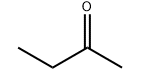
Struktura molekularna produktu:
Specyfikacja:
| Przedmiot | Jednostka | Wartość |
| Czystość | % | 99,8 minuty |
| Kolor | APHA | 8max |
| Liczba kwasowa (w przeliczeniu na kwas octanowy) | % | 0,002maks. |
| wilgoć | % | 0,03 maks. |
| Wygląd | - | Bezbarwna ciecz |
Właściwości chemiczne:
Metyloetyloketon jest podatny na różne reakcje ze względu na swoją grupę karbonylową i aktywny wodór przylegający do grupy karbonylowej. Kondensacja zachodzi po ogrzaniu z kwasem solnym lub wodorotlenkiem sodu, tworząc 3,4-dimetylo-3-heksen-2-on lub 3-metylo-3-hepten-5-on. Pod wpływem długotrwałego działania światła słonecznego powstaje etan, kwas octowy i produkty kondensacji. Utlenianie kwasem azotowym generuje diacetyl. Utlenianie silnymi utleniaczami, takimi jak kwas chromowy, powoduje powstanie kwasu octowego. Butanon jest stosunkowo stabilny w wysokiej temperaturze, a rozszczepienie termiczne w wyższych temperaturach prowadzi do enonu lub metyloenonu. Kondensacja z aldehydami alifatycznymi lub aromatycznymi prowadzi do powstania ketonów o dużej masie cząsteczkowej, związków cyklicznych, kondensacji ketonów i żywic. Na przykład kondensacja z formaldehydem w obecności wodorotlenku sodu najpierw wytwarza 2-metylo-1-butanol-3-on, a następnie następuje dehydratacja do metakrylatonu.
Resinizacja zachodzi pod wpływem światła słonecznego lub promieniowania UV. Kondensacja z fenolem prowadzi do powstania 2,2-bis(4-hydroksyfenylo)butanu. Reaguje z estrami alifatycznymi w obecności katalizatora zasadowego, tworząc β-diketony. Acylowanie bezwodnikiem kwasowym w obecności katalizatora kwasowego prowadzi do powstania β-diketony. Reaguje z cyjanowodorem, tworząc cyjanohydrynę. Reaguje z amoniakiem, tworząc pochodne ketopiperydyny. Atom wodoru α butanonu jest łatwo podstawiany halogenami, tworząc różne halogenowane ketony, takie jak 3-chloro-2-butanon, poprzez interakcję z chlorem. Interakcja z 2,4-dinitrofenylohydrazyną prowadzi do powstania żółtego 2,4-dinitrofenylohydrazonu.
Aplikacja:
Metyloetyloketon (2-butanon, etylometyloketon, metyloaceton) to rozpuszczalnik organiczny o stosunkowo niskiej toksyczności, który znajduje zastosowanie w wielu dziedzinach. Jest stosowany w produktach przemysłowych i komercyjnych jako rozpuszczalnik do klejów, farb i środków czyszczących oraz jako rozpuszczalnik do usuwania wosku. Metyloetyloketon, naturalny składnik niektórych produktów spożywczych, może być uwalniany do środowiska przez wulkany i pożary lasów. Jest stosowany w produkcji prochu bezdymnego i bezbarwnych żywic syntetycznych, jako rozpuszczalnik oraz w powłokach powierzchniowych. Jest również stosowany jako substancja aromatyzująca w żywności.
MEK jest stosowany jako rozpuszczalnik w różnych systemach powłokowych, na przykład w powłokach winylowych, klejach, nitrocelulozie i akrylowych. Jest stosowany w zmywaczach do farb, lakierach, werniksach, farbach w sprayu, uszczelniaczach, klejach, taśmach magnetycznych, farbach drukarskich, żywicach, kalafoniach, roztworach czyszczących oraz w polimeryzacji. Występuje również w innych produktach konsumenckich, na przykład w cementach do użytku domowego i hobbystycznego oraz w produktach do wypełniania drewna. MEK jest stosowany do odparafinowania olejów smarowych, odtłuszczania metali, w produkcji skór syntetycznych, papieru transparentnego i folii aluminiowej, a także jako półprodukt chemiczny i katalizator. Jest rozpuszczalnikiem ekstrakcyjnym w przetwórstwie żywności i składników żywności. MEK może być również stosowany do sterylizacji sprzętu chirurgicznego i stomatologicznego.
Oprócz produkcji, źródłami MEK w środowisku są spaliny silników odrzutowych i spalinowych oraz procesy przemysłowe, takie jak zgazowanie węgla. Występuje on w znacznych ilościach w dymie tytoniowym. MEK jest produkowany biologicznie i został zidentyfikowany jako produkt metabolizmu drobnoustrojów. Wykryto go również w roślinach, feromonach owadów i tkankach zwierzęcych, a MEK jest prawdopodobnie niewielkim produktem normalnego metabolizmu ssaków. Jest stabilny w normalnych warunkach, ale podczas długotrwałego przechowywania może tworzyć nadtlenki, które mogą być wybuchowe.
Kategorie produktów
-

Telefon
-

E-mail
-

WhatsApp
-

Szczyt













